ADP: El compuesto resultante de la pérdida de un fosfato se llama difosfato de adenosina, adenosín difosfato.
AMP: si se pierden dos se llama monofosfato de adenosina, adenosín monofosfato.
PMPT: poro mitocondrial de permeabilidad transitoria.
Apaf-1:La proteína Apaf-1 (Apoptosis protease-activating factor-1) es ,un regulador clave de la vía apoptótica mitocondrial, siendo el elemento central del complejo multimérico denominado apoptosoma, formado también por la procaspasa-9 y el citocromo c.
Las actividades Apaf se describieron por primera vez en experimentos in vitro para recuperar la actividad caspasa a partir de fracciones citosólicas de células HeLa. Apaf-1 resultó ser una molécula adaptadora con homología con la proteína CED-4 de C. elegans, mientras que Apaf-2 y Apaf-3 fueron identificados como el citocromo c y la caspasa-9 respectivamente (Zou et al. 1997).
La formación del apostema.
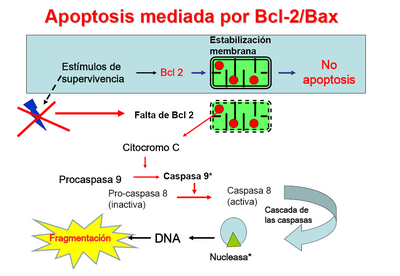
La formación de la estructura del apoptosoma se desencadena con la liberación de la mitocondria del citocromo c mediada por la familia Bcl-2. Una vez liberado, el citocromo c se une a Apaf-1 formando un primer complejo. Esta unión viene definida por la existencia en el extremo C-terminal de Apaf-1 de varios dominios WD40 de unión proteína-proteína como los presentes en la subunidad b de las proteínas G heterotriméricas. Apaf-1 presenta también un dominio de reclutamiento de caspasas (CARD) que, en condiciones de inactividad, estaría “secuestrado” por dos de los dominios WD40, pero que se libera con la unión del citocromo c. La exposición de los dominios CARD permite a Apaf-1 reclutar a la procaspasa-9 en presencia de dATP que media la oligomerización del complejo. Una vez unida, la procaspasa-9 sufre un autoprocesamiento dando lugar a su forma activa de caspasa-9, una caspasa iniciadora capaz de activar caspasas efectoras como la caspasa-3. Esta sucesión de acontecimientos acaba desembocando en la activación de otras caspasas y de factores de degradación de ADN que se encargarían de fragmentar el material genético.Bcl-2: Bcl-2 es una familia de proteínas formada por alrededor de 25 miembros que regulan procesos de permeabilización mitocondrial y constituyen un punto clave en la vía intrínseca de apoptosis celular.
Estas subfamilias vienen definidas en parte por la homología con cuatro regiones denominadas dominios de homología Bcl-2 (BH). La subfamilia anti-apoptótica presenta una conservación de los 4 dominios y estudios con Bcl-W permitieron determinar que los dominios BH1, BH2 y BH3 eran los responsables de formar una región hidrofóbica de interacción con los dominios BH3 de las pro-apoptóticas, produciendo su inhibición. Los miembros de la subfamilia Bax presentan dominios BH1-3 por lo que también se les conoce como subfamilia “multidominio”, en contraposición con la subfamilia BH3 que sólo presenta homología en el mínimo dominio de muerte celular, la hélice anfipática BH3.Células deficientes en BAX y BAK se han observado como resistentes a todos los estímulos conocidos de la vía de muerte celular intrínseca por lo que se les considera un requisito indispensable para que la vía resulte operativa. En células viables, BAX y BAK aparecen como monómeros, la primera anclada laxamente en la cara citosólica de diversos orgánulos y la segunda en el interior de la mitocondria. Ante una señal de muerte celular BAX se inserta en la membrana externa mitocondrial en forma de homooligómero y BAK sufre a su vez un cambio conformacional que incluye su oligomerización y la permeabilización de la membrana externa mitocondrial con la liberación de factores del espacio intermembrana como el citocromo c. El mecanismo exacto de esta liberación se desconoce aunque se plantean dos teorías principales. La primera postularía que las formas oligoméricas de BAX y BAK crearían poros capaces de liberar el citocromo c basándose en su similitud con toxinas bacterianas formadoras de poros y a la evidencia de experimentos in vitro. Una segunda teoría afirmaría que BAX y BAK interaccionarían con moléculas intrínsecas de membrana y producirían una transición de permeabilidad. Estos mismos procesos tendrían lugar en el retículo endoplásmico mediando la liberación de Ca2+.
Su nombre deriva de la proteína fundadora, el protooncogén Bcl-2 (B-cell lymphoma 2), segundo miembro de un grupo de proteínas inicialmente descrito en estudios de la translocación recíproca entre los cromosomas 14 y 18 observada en linfomas foliculares. A diferencia de otros oncogenes estudiados hasta la fecha, Bcl-2 no estaba implicado en el control de la proliferación celular sino en el bloqueo de la muerte celular, más específicamente de los procesos de contracción citoplasmática, condensación nuclear, desorganización de la membrana plasmática y ruptura endonucleolítica del ADN. A su vez, por su localización mitocondrial, fue un primer indicador de la importancia de este orgánulo en los procesos de apoptosis. Siguientes investigaciones demostraron la existencia de dos subfamilias homólogas pro-apoptóticas, Bax y BH3. Bax fue el primer homólogo identificado por su interacción con Bcl-2: ratones deficientes en Bax presentaban una expansión selectiva de poblaciones celulares y la relación Bcl-2/Bax se descubrió clave en la susceptibilidad a apoptosis por la vía intrínseca.
- Subfamilia Bcl-2 (anti-apoptótica): Bcl-2, Bcl-XL, Bcl-W, MCL-1, BCL2A1, BCL-B
- Subfamilia Bax (pro-apoptótica): Bax, Bak, Bok
- Subfamilia BH3 (pro-apoptótica): Bad, Bid, Bik, Blk, BimL, PUMA, NOXA, BMF, HRK
Estas subfamilias vienen definidas en parte por la homología con cuatro regiones denominadas dominios de homología Bcl-2 (BH). La subfamilia anti-apoptótica presenta una conservación de los 4 dominios y estudios con Bcl-W permitieron determinar que los dominios BH1, BH2 y BH3 eran los responsables de formar una región hidrofóbica de interacción con los dominios BH3 de las pro-apoptóticas, produciendo su inhibición. Los miembros de la subfamilia Bax presentan dominios BH1-3 por lo que también se les conoce como subfamilia “multidominio”, en contraposición con la subfamilia BH3 que sólo presenta homología en el mínimo dominio de muerte celular, la hélice anfipática BH3.
Mecanismo de acción:
Los miembros de la subfamilia BH3 funcionarían como iniciadores de la vía que integrarían de forma selectiva las diversas respuestas específicas de muerte y supervivencia. Por ejemplo, la caspasa-8 activada por señales de receptores de muerte celular en superficie origina una serie de modificaciones de la proteína BID que servirá como ligando para favorecer la oligomerización de Bax y Bak y, por lo tanto, su activación. La actividad de esta subfamilia está regulada a nivel transcripcional y postraduccional como, por ejemplo, por factores como p53 en respuesta a daño genético o por fosforilación en respuestas a factores de crecimiento. Actualmente se estudia si todas las moléculas de la familia BH3 tendrían funciones idénticas o podrían llegar a ser incluso excluyentes entre sí.
Relevancia clínica:
La familia Bcl-2, aparte de en el linfoma folicular de células B, está implicada en un gran número de cánceres, incluyendo el melanoma y los carcinomas de pecho, próstata y pulmón. También se cree relacionado con la resistencia a los tratamientos antitumorales convencionales.http://es.wikipedia.org/wiki/Bcl-2
Homeostasis (Del griego 'homos (ὅμος) que significa "similar" y estasis (στάσις) "posición", "estabilidad") es la característica de un sistema abierto o de un sistema cerrado o una conjugación entre ambos, especialmente en un organismo vivo, mediante la cual se regula el ambiente interno para mantener una condición estable y constante. La homeostasis es posible gracias a los múltiples ajustes dinámicos del equilibrio y los mecanismos de autorregulación. El concepto fue creado por Walter Cannon para referirse al concepto de medio interno (mileu interiur) de Claude Bernard, considerado a menudo como el padre de la fisiología, y publicado en 1865. Tradicionalmente se ha aplicado en biología pero, dado el hecho de que no sólo lo biológico es capaz de cumplir con esta definición, otras ciencias y técnicas han adoptado también este término.
http://es.wikipedia.org/wiki/Homeostasis
Homeostasis (Del griego 'homos (ὅμος) que significa "similar" y estasis (στάσις) "posición", "estabilidad") es la característica de un sistema abierto o de un sistema cerrado o una conjugación entre ambos, especialmente en un organismo vivo, mediante la cual se regula el ambiente interno para mantener una condición estable y constante. La homeostasis es posible gracias a los múltiples ajustes dinámicos del equilibrio y los mecanismos de autorregulación. El concepto fue creado por Walter Cannon para referirse al concepto de medio interno (mileu interiur) de Claude Bernard, considerado a menudo como el padre de la fisiología, y publicado en 1865. Tradicionalmente se ha aplicado en biología pero, dado el hecho de que no sólo lo biológico es capaz de cumplir con esta definición, otras ciencias y técnicas han adoptado también este término.
http://es.wikipedia.org/wiki/Homeostasis
No hay comentarios:
Publicar un comentario